Modèle de Drude-Lorentz généralisé à partir du développement en singularités de la permittivité diélectrique
Déterminer l’indice de réfraction de matériaux grâce à l’analyse complexe
Modèle de Drude-Lorentz généralisé à partir du développement en singularités de la permittivité diélectrique
Les propriétés électromagnétiques des matériaux sont décrites par la permittivité diélectrique et la perméabilité magnétique apparaissant dans les relations de constitution harmoniques des équations de Maxwell. La connaissance de ces paramètres est cruciale afin de pouvoir décrire correctement la réponse électromagnétique de matériaux et de composants. La description de la permittivité diélectrique dans le domaine harmonique est basée sur des modèles microscopiques des électrons dans la matière. Le modèle de Debye, Drude et Lorentz, en particulier, est très largement utilisé pour modéliser la permittivité. Il contient des paramètres libres qui sont déterminés afin d’ajuster l’expression analytique aux mesures spectrales expérimentales de permittivité. Mais la permittivité diélectrique est une fonction de transfert dépendant de la fréquence et elle peut être étendue dans le plan des fréquences complexes. Dans le domaine harmonique, son comportement est régi par certaines fréquences complexes particulières, appelées singularités, pour lesquelles elle devient infinie. La fonction de transfert doit ainsi satisfaire aux propriétés associées à l’analyse complexe des fonctions méromorphes. La question se pose alors de savoir si les modèles microscopiques de Drude et de Lorentz satisfont ces règles et si les développements récents sur l’expansion en singularités de fonctions de transfert permettent d’exprimer la permittivité diélectrique de matériaux.
Une équipe de recherche de l’Institut Fresnel (CNRS, Aix Marseille Université, Centrale Méditerranée) a montré comment exprimer la permittivité diélectrique suivant ses singularités dans le plan complexe des fréquences et a montré que son développement en singularités pouvait s’écrire sous la forme d’une expression de Drude-Lorentz généralisée. Cette nouvelle expression de la permittivité se distingue notamment des formes conventionnelles du modèle de Drude-Lorentz par un terme supplémentaire, imaginaire et dépendant de la fréquence, au numérateur des termes de Lorentz.
Les chercheurs ont par la suite évalué la précision de cette nouvelle expression sur des mesures tabulées de permittivité diélectrique de différents matériaux. Ils ont montré qu’il était possible de déterminer, à partir de ces données expérimentales effectuées à des fréquences réelles, les singularités dans le plan des fréquences complexes. Le gain de précision de la méthode a été démontré pour tous les matériaux considérés (diélectriques, métaux, matériaux 2D). Cette approche est générale et peut être appliquée à tout type de fonctions de transfert, comme les éléments de la matrice de diffusion S très largement utilisée en physique des ondes comme en acoustique, électronique ou en optique et en électromagnétisme.
Ces travaux ont été publiés en accès libre et font la couverture du numéro d’avril de la revue Advanced Optical Materials.
Référence :
I. Ben Soltane, F. Dierick, B. Stout, N. Bonod, Generalized Drude-Lorentz Model Complying with the Singularity Expansion Method Adv. Optical Mater., 2400093 (2024)
https://doi.org/10.1002/adom.202400093
https://doi.org/10.48550/arXiv.2401.05756
Contacts :
Isam Ben Soltane, isam.ben-soltane@fresnel.fr & Nicolas Bonod,nicolas.bonod@fresnel.fr
La microscopie polarisée, sonde des organisations moléculaires aux échelles nanométriques
Polarization microscopy : from ensemble structural imaging to single molecule 3D orientation & localization microscopy
Dans cet article, les auteurs donnent un aperçu complet du domaine en plein essor de la microscopie polarisée. Un large éventail de techniques mathématiques, informatiques et expérimentales ont été développées dans le but d’utiliser la propriété de la lumière connue sous le nom de polarisation, pour former des images qui nous indiquent non seulement où se trouvent les molécules composant un milieu, mais aussi comment elles sont orientées. Ces informations sur l’orientation sont importantes pour comprendre la structure fine de l’échantillon mesuré. La lumière est une onde et, en tant que telle, elle peut osciller de différentes manières ; la polarisation se réfère précisément à la géométrie de ces oscillations. Lorsque la lumière est fortement focalisée, la complexité de ces oscillations augmente, ce qui permet de sonder la matière de différentes manières. L’article décrit également de nombreuses orientations futures possibles pour l’amélioration et la généralisation de la microscopie polarisée.

Références :
https://opg.optica.org/optica/fulltext.cfm?uri=optica-10-11-1486&id=542276
Partenaires : Aix Marseille Université, CNRS, Centrale Méditerranée, Institut Fresnel, The Institute of Optics, Université de Rochester-USA
Financements : Agence Nationale de la Recherche - ANR-20-CE42-0003, ANR-21-CE24-0014, France 2030 Investment Plan IDEC ANR-21-ESRE-0002, Investissements d’Avenir CENTURI ANR-16-CONV-0001, France BioImaging National Infrastructure ANR-10-INBS-04.
Contacts :
Sophie BRASSELET – équipe MOSAIC group, Directrice de l’Institut Fresnel - UMR7249.
Miguel ALONSO – équipe MOSAIC, Institut Fresnel - http://miguel.alonso.perso.centrale-marseille.fr
Une lame quart d’onde en silice nanostructurée pour manipuler la polarisation des faisceaux du Laser MégaJoule et réduire l’effet Kerr d’aufocalisation
Plusieurs chaînes laser de haute énergie sont en cours de montage et d’exploitation dans le monde pour initier de la fusion nucléaire par confinement inertiel, notamment au LLNL avec le National Ignition Facility (NIF, Livermore USA) et au CEA CESTA avec le laser Mégajoule (LMJ, Le Barp-Bordeaux). L’approche par confinement laser a franchi des étapes importantes ces dernières années, notamment en décembre 2022 lorsque le NIF a annoncé avoir obtenu pour la première fois un gain entre l’énergie générée par la réaction de fusion et l’énergie des faisceaux laser ayant permis de l’initier.
Le laser Mégajoule comprend 176 faisceaux délivrant des impulsions laser nanosecondes polarisées linéairement. Après amplification dans le proche infrarouge et triplement de fréquence pour atteindre une longueur d’onde de 351 nm, ces faisceaux convergent vers une cible située au centre d’une grande chambre d’expérience, chambre sphérique d’une dizaine de mètres de diamètre. Pour accéder à l’intérieur de la chambre, les faisceaux doivent traverser des hublots transparents répartis autour de la chambre. Ces hublots en silice sont des éléments critiques car ils assurent le vide à l’intérieur de la chambre et parce que, situés en bout de chaîne laser, ils sont traversés par des faisceaux dont l’énergie est alors maximale. L’intensité des faisceaux peut conduire à la génération d’effet Kerr, un effet non linéaire du 3° ordre, capable d’entrainer une auto-focalisation des faisceaux dans le verre. L’auto-focalisation par effet Kerr peut endommager la matière en créant de multiples filaments qui posent un véritable défi pour l’augmentation en énergie/puissance des installations laser énergétiques de type NIF/LMJ.
Pour contrer ce phénomène, des chercheurs du CEA-CESTA, du CEA-LETI et de l’Institut Fresnel (CNRS, AMU, Centrale Marseille) ont tiré profit d’une propriété de cet effet non linéaire : l’effet Kerr dépend de la polarisation du faisceau laser et peut être réduit en basculant d’une polarisation linéaire à une polarisation circulaire. Mais comment manipuler la polarisation de faisceaux laser si énergétiques ? En effet, si une telle lame, dite « quart-d’onde », permet de convertir une polarisation linéaire en une polarisation circulaire, les matériaux anisotropes classiquement utilisés pour réaliser ces composants ne peuvent être traversés par des faisceaux laser aussi énergétiques sans s’endommager au gré des tirs. La silice amorphe est le matériau le plus indiqué pour ces faisceaux, mais elle est de nature isotrope et n’a alors aucune influence sur la polarisation du faisceau en incidence normale…
L’idée suivie par l’équipe de recherche est la suivante : créer une anisotropie en structurant la silice amorphe avec des sillons linéaires profonds et très rapprochés. Plusieurs difficultés se présentent pour concevoir et réaliser cette lame quart d’onde si particulière : la période de structuration doit être inférieure à la longueur d’onde du laser qui est ici très courte pour ces faisceaux laser UV à 351 nm, le rapport d’aspect (rapport entre la hauteur et la largeur des motifs) doit être supérieur à 4 pour compenser le faible écart d’indice de réfraction entre la silice et l’air, le retard de phase doit être associé à une transmittance quasi parfaite et le procédé de fabrication doit être non polluant afin de permettre à la lame quart d’onde de supporter les hautes fluences de ces chaînes laser.

L’équipe de recherche a tout d’abord montré dans une première étude1 la possibilité de réaliser une lame en silice nanostructurée de 5×5cm2 d’une période de 260 nm et d’une profondeur de gravure de 750 nm capable de répondre à ce cahier des charges, en induisant un retard de phase équivalent à /5 avec une transmittance supérieure à 95%. Les tests d’endommagement ont montré que ces lames en silice sont capables de supporter des fluences laser très élevées sans s’endommager. Dans un second temps, l’équipe a développé une seconde version de cette méta-optique sur une surface utile de 11×11cm2 avec une période encore plus courte (230 nm), afin d’améliorer la transmittance, une profondeur de gravure atteignant 1µm leur permettant d’atteindre une conversion de polarisation optimale, et deux orientations de gravures permettant de générer, suivant la zone éclairée, une polarisation circulaire droite ou gauche. Cette méta-optique a été utilisée afin de réaliser des tests de filamentation dans du verre en polarisations linéaire et circulaire. Les mesures ont montré qu’à une fluence de l’ordre de 5 J/cm2, une polarisation circulaire permet d’éviter tout phénomène de filamentation pourtant bien présent en polarisation linéaire. A une fluence de 7 J/cm2, la polarisation circulaire permet de réduire le taux de filamentation à un taux équivalent à celui observé à 5 J/cm2 en polarisation linéaire2.
Ces travaux montrent l’intérêt du contrôle de la polarisation pour le développement de chaines laser de haute énergie, et de l’approche des métasurfaces pour concevoir des lames d’onde en silice capables de supporter de telles fluences lasers. Outre le bénéfice d’un tel composant pour repousser le seuil d’apparition de l’effet Kerr, il peut également être utilisé pour manipuler la polarisation à des fins de lissage optique dans le but de limiter les instabilités paramétriques lors de l’interaction laser/cible. L’enjeu à venir réside dorénavant dans l’augmentation de la dimension de ces composants optiques pour envisager une potentielle intégration sur la chaine laser.
Références
N. Bonod, P. Brianceau, J. Néauport, “Full-Silica Metamaterial Wave Plate for High-Intensity UV Lasers” Optica 8, 1372-1379 (2021)
N. Bonod, P. Brianceau, J. Daurios, S. Grosjean, N. Roquin, J.-F. Gleyze, L. Lamaignère, J. Néauport, “Linear-to-Circular Polarization Conversion with Full-Silica Meta-Optics to Reduce Nonlinear Effects in High-Energy Lasers” Nature Commun. 14, 5383 (2023)
Des illuminations de lumière aléatoires à la rescousse de l’imagerie chimique
Les illuminations aléatoires pour aller plus vite et minimiser l’endommagement des échantillons
Les techniques dites de Raman Cohérent permettent de visualiser des groupements chimiques présents dans les échantillons sans utiliser aucun marquage. Il s’agit d’utiliserdeux faisceaux lasers dont la différence de fréquence est égale à la fréquence de vibration de la liaison chimique que l’on veut visualiser.
L’approche conventionnelle utilise des lasers focalisés en un point qui balayent l’échantillon à l’aide de miroir mobiles, l’image est alors reconstruite point par point et est limitée par le temps nécessaire aux faisceaux lasers pour balayer l’échantillon. Augmenter la vitesse de balayage implique l’augmentation de la puissance des lasers ce qui conduit inévitablement à un photo-endommagement de l’échantillon.
Des chercheurs de l’Institut Fresnel à Marseille, en collaboration avec des collègues lithuaniens et américains ont récemment développé une nouvelle méthode pour imager les groupements chimiques des molécules n’utilisant pas un balayage laser de l’échantillon mais une imagerie en champ large utilisant une caméra. Pour cela, ils ont utilisé une illumination de l’échantillon avec des tavelures (speckle) aléatoires qui ont l’avantage de garder leurs propriétés statistiques lorsqu’elles se propagent dans un milieu diffusant comme les tissues biologiques. En changeant les illuminations de speckle ils ont pu démontrer (1) qu’il est possible d’imager des liaisons chimiques ne se trouvant que dans le plan d’imagerie, réalisant ainsi un sectionnement optique virtuel, et (2) qu’il est possible d’améliorer la résolution d’un facteur 2. Par ailleurs ce mode d’illumination permet de préserver l’échantillon des endommagements liés à l’illumination laser et permettre ainsi d’imager l’échantillon sur le long terme.
Ce nouveau mode d’imagerie doit permettre d’avancer les recherches dans les domaines de la biologie, de la pharmacologie et de la médecine, en particulier pour détecter rapidement les tissus cancéreux.
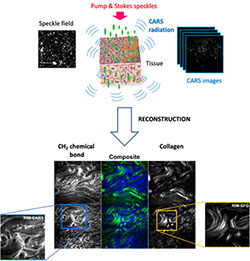
Référence : E. M. Fantuzzi, S. Heuke, S. Labouesse, D. Gudavičius, R. Bartels, A. Sentenac, and H. Rigneault, "Wide-field coherent anti-Stokes Raman scattering microscopy using random illuminations" Nature Photonics (2023).
DOI : 10.1038/s41566-023-01294-x
Article mis en valeur dans INFUSE, le magazine de la recherche d’AMU "L’illumination aléatoire à la rescousse de l’imagerie"
- Voir aussi l’article "Imagerie moléculaire vibrationnelle un nouvel outil pour la biologie et la médecine" dans le revue Photoniques, N°96, Mai-Juin 2019 (p.18 à 22)
Financement : ERC AdG SpeckleCARS (101052911) - EU ICT 101016923 CRIMSON, Marie Skłodowska-Curie Actions ITN 812992 MUSIQ
Contact : herve.rigneault@fresnel.fr, sandro.heuke@fresnel.fr, anne.sentenac@fresnel.fr
Imagerie de la structure interne d’un analogue d’astéroïde à partir de mesures micro-ondes
Cette étude concerne l’imagerie de la structure interne des astéroïdes et a été réalisée sur un analogue de l’astéroïde (25143) Itokawa, un astéroïde rencontré par la mission Hayabusa de l’agence spatiale japonaise JAXA en 2005.
Ces travaux ont été conduits dans le cadre d’une collaboration entre des chercheurs du département de mathématiques et de statistiques de l’université de Tampere en Finlande et des chercheurs de l’Institut Fresnel à Marseille. Ils ont donné lieu à deux articles conjoints publiés dans la revue Astronomy & Astrophysics. Dans ces articles, une étude des procédures d’imagerie exploitant l’interaction des ondes électromagnétiques avec les astéroïdes est proposée avec l’idée de faire progresser le développement des techniques d’inversion à utiliser pour les futures études radar de science planétaire ciblant les petits corps du système solaire (SSSB). La configuration la plus courante pour les radars spatiaux, une configuration monostatique, a été choisie.
Deux analogues de cet astéroïde ont été construits par impression 3D, en respectant autant que possible les connaissances actuelles sur cet astéroïde. Des mesures de diffraction par ces analogues dans la gamme de fréquences des micro-ondes ont été effectuées dans un environnement de laboratoire contrôlé (chambre anéchoïque, figure 1). Nous avons étudié la possibilité d’imager la structure interne de ces analogues avec deux procédures différentes, l’une dans le domaine fréquentiel (partie 1 de l’étude) et l’autre dans le domaine temporel (partie 2 de l’étude). Toutes les inversions ont été effectuées en utilisant le même jeu mesures. Les résultats montrent qu’avec ces deux approches, il est possible d’obtenir la structure interne des analogues et de l’imager à partir de ces mesures de type radar monostatique (figures 2 et 3). Ceci est encourageant pour pouvoir exploiter les données des futures missions avec radar vers les astéroides, comme la mission HERA de l’ESA, avec à son bord un radar, dont le départ est prévu l’année prochaine vers l’astéroïde binaire (65803) Didymos.
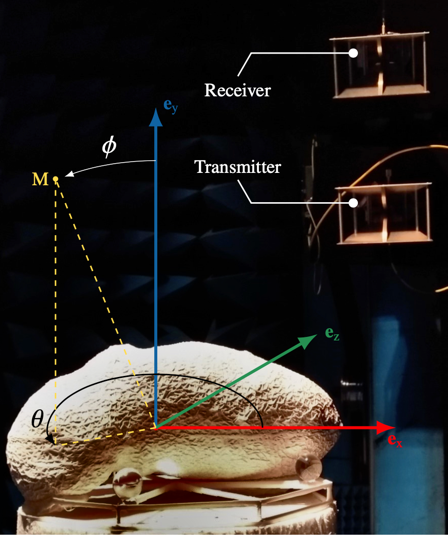
Référence :
[1] A. Dufaure, C. Eyraud, L-I. Sorsa, Y.O. Yusuf, S. Pursiainen, and J-M. Geffrin, Imaging of the internal structure of an asteroid analogue from quasi-monostatic microwave measurements. Part 1 : The frequency domain approach., Astronomy & Astrophysics, Vol. 674, art. A72, june 2023
[2] L.-I. Sorsa, Y.O. Yusuf, A. Dufaure, J-M. Geffrin, C. Eyraud and S. Pursiainen, Imaging of the internal structure of an asteroid analogue from quasi-monostatic microwave measurements. Part 2 : The time domain approach., Astronomy & Astrophysics, Vol. 674, art. A73, june 2023
Part I - https://doi.org/10.1051/0004-6361/202244777
Part II - https://doi.org/10.1051/0004-6361/202244778
Partenariat : Cette recherche est le résultat d’un travail collaboratif entre des chercheurs du département de Mathematics and Statistics de l’Université de Tampere(Liisa-Ida Sorsa, Sampsa Pursiainen, Yusuf Oluwatoki Yusuf) et des chercheurs de l’équipe HIPE à l’Institut Fresnel (Astrid Dufaure, Christelle Eyraud, Jean-Michel Geffrin).
Que le Centre de Calcul Intensif d’Aix-Marseille et le CSC - IT Center for Science Ltd. soient ici remerciés pour l’accès à leurs ressources de calcul à haute performance. Nous remercions aussi le Centre Commun de Ressources en Microonde de nous avoir permis d’utiliser leur chambre anéchoïque entièrement équipée. Les chercheurs finlandais bénéficient du soutien du Centre d’excellence en modélisation inverse et imagerie (Académie de Finlande 2018-2025, numéro de projet 312341) et de l’Académie de Finlande, numéro de projet 336151.
Contact Chercheur : Christelle EYRAUD – Équipe HIPE, Institut Fresnel.
Une combinaison d’essais acellulaires et d’études en cellules permet de mieux comprendre l’organisation et la fonction des septines humaines.
Ces travaux sont publiés dans le Journal of Cell Biology.
Un système rapporteur basé sur la fluorescence qui sonde les interactions spécifiques septine-septine révèle que les septines humaines dans les cellules s’organisent en filaments qui ancrent les fibres d’actine à la membrane cellulaire.
Les septines constituent une famille de protéines impliquées dans un large spectre de processus biologiques, de la division cellulaire à la motilité cellulaire et à la morphogenèse des tissus animaux. En physiopathologie humaine, un rôle des septines a été établi dans les neuropathies, l’infertilité et la tumorigenèse. Malgré leurs rôles essentiels, la façon dont les septines humaines s’organisent et fonctionnent dans les cellules reste mal comprise. Un travail collaboratif entre des biologistes de l’Institut Fresnel et du Centre de Recherche en Cancérologie de Toulouse (CRCT) et des physiciens de l’Institut Fresnel et de TU Delft (Martins et al. 2022) aborde cette question en combinant des études cellulaires avec des essais de reconstitution in vitro. En développant un système rapporteur basé sur la fluorescence comme signature moléculaire des interactions spécifiques septine-septine, les auteurs montrent que toutes les septines décorant les fibres d’actine dans les cellules s’organisent en filaments. Empêcher la polymérisation des septines compromet l’intégrité des fibres d’actine et réduit la rigidité des cellules. Des mesures de distance à résolution nanométrique ont également montré que les filaments de septine sont liés à la membrane. Enfin, des essais de reconstitution ont montré que les filaments de septine ancrent l’actine à la membrane. Cette étude montre que l’organisation des septines en filaments est essentielle à leur fonction d’ancrage et de stabilisation des filaments d’actine à la membrane plasmique.
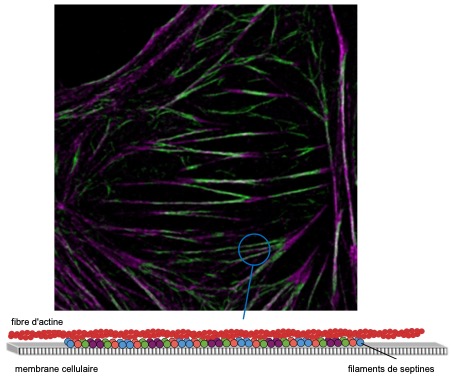
Référence : Human septins organize as octamer-based filaments and mediate actin-membrane anchoring in cells, Carla Silva Martins, Cyntia Taveneau, Gerard Castro-Linares, Mikhail Baibakov, Nicolas Buzhinsky, Mar Eroles, Violeta Milanović, Shizue Omi, Jean-Denis Pedelacq, François Iv, Léa Bouillard, Alex Llewellyn, Maxime Gomes, Mayssa Belhabib, Mira Kuzmić, Pascal Verdier-Pinard, Stacey Lee, Ali Badache, Sanjay Kumar, Cristel Chandre, Sophie Brasselet, Felix Rico, Olivier Rossier, Gijsje H. Koenderink, Jerome Wenger, Stéphanie Cabantous, Manos Mavrakis in Journal of Cell Biology, 2022
https://doi.org/10.1083/jcb.202203016
Contact : Manos MAVRAKIS - équipe MOSAIC - manos.mavrakis@univ-amu.fr
Partenaires : Cette recherche est le fruit d’une collaboration entre l’Institut Fresnel, le Centre de Recherche en Cancérologie de Toulouse (CRCT), le Laboratoire Adhésion et Inflammation (LAI), l’Institut Interdisciplinaire de Neurosciences (IINS), l’Institut de Pharmacologie et de Biologie Structurale (IPBS), le Centre de Recherche en Cancérologie de Marseille (CRCM), l’Institut de Mathématiques de Marseille (I2M), TU Delft, l’Université Monash et UC Berkeley.
Financements : Cette recherche a reçu plusieurs financements
de l’Agence Nationale de la Recherche (subventions ANR-17-CE13-0014 SEPTIMORF. ; ANR-17-CE09-0026-01 AntennaFRET ; ANR-20-CE42-0003 3DPolariSR)
de la Fondation ARC pour la recherche sur le cancer (subvention ARCDOC42020010001242) et des Cancéropôles PACA et INCa
du Conseil Européen de la Recherche (ERC) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’UE (subventions n° 723241 et n° 772257) et de l’Union Européenne (subvention H2020-MSCA-ITN-2018 n°812772).
de l’Organisation néerlandaise pour la recherche scientifique (NWO/OCW) (subvention Gravitation ’BaSyC-Building a Synthetic Cell’ (024.003.019)
Obtention de la sensibilité ultime de détection UV des protéines
Débloquer le potentiel de la détection de protéines sans marquage : atteindre la sensibilité ultime avec l’autofluorescence UV et la nanophotonique
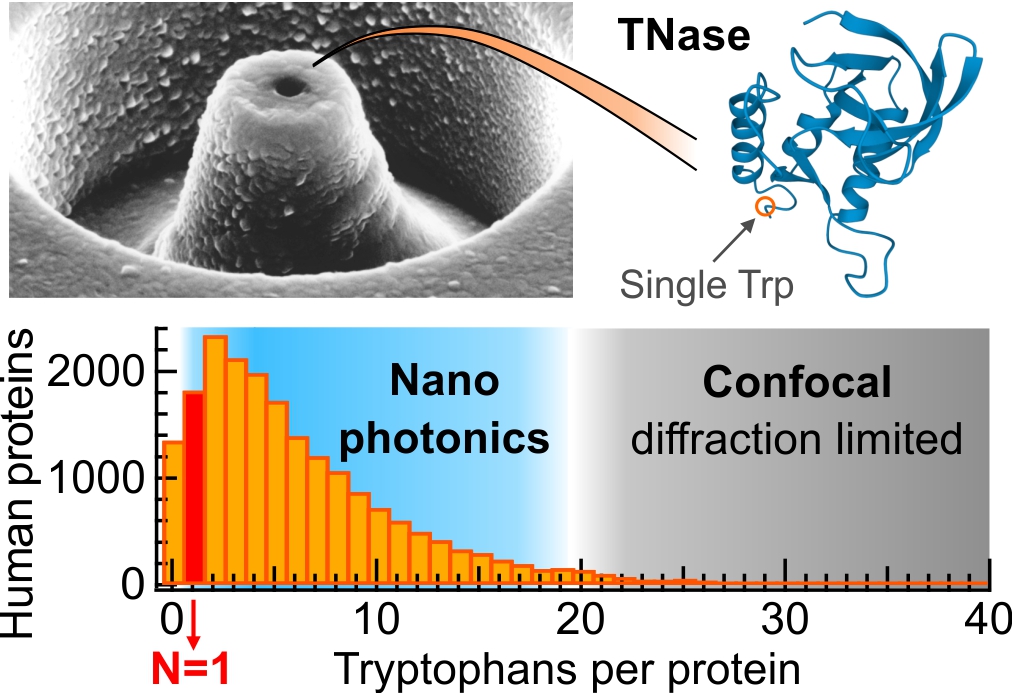
Les protéines sont naturellement fluorescentes dans l’ultraviolet, ce qui offre une approche attrayante pour étudier des protéines natives sans introduire des marqueurs fluorescents externes. L’autofluorescence UV des protéines se base sur la présence d’acides aminés tryptophane, généralement présents en faible nombre dans une protéine (en moyenne de 1 à 5 tryptophane par protéine). Cependant, en raison de signaux faibles et de fonds importants dans les UV, la technologie actuelle était limitée aux grosses protéines contenant plusieurs dizaines de tryptophanes. La grande majorité des protéines restait bien en deçà de la sensibilité de détection pour la détection d’une seule protéine sans marquage.
Une équipe de chercheurs de l’Institut Fresnel franchit cette limite de sensibilité et réalise une détection par autofluorescence UV sans marqueur jusqu’au niveau du tryptophane unique. L’approche repose sur une combinaison rationnelle de nanoantennes plasmoniques, d’antioxydants et de techniques de réduction du bruit de fond pour améliorer le rapport signal sur fond de plus d’un ordre de grandeur. Atteindre la sensibilité ultime de la technique UV-FCS jusqu’au régime du tryptophane unique a de nombreuses applications pour diverses communautés, de la nanophotonique à la biochimie.
Notre équipe démontre de manière concluante la spectroscopie de corrélation de fluorescence UV (UV-FCS) sur des protéines avec un seul résidu de tryptophane. Cela ouvre l’applicabilité de l’UV-FCS à une large bibliothèque de milliers de protéines, qui restaient auparavant inaccessibles (plus de 90 % des protéines humaines ont au moins un résidu de tryptophane, mais seulement 4 % ont plus de 20 tryptophanes). La spectroscopie de corrélation de fluorescence (FCS) et les techniques associées ont un impact important sur la biophysique moléculaire dans l’évaluation des propriétés de diffusion, des concentrations locales ou des taux de réactions cinétiques.
L’approche de maximisation du signal intéresse un large éventail de scientifiques et d’ingénieurs travaillant avec la fluorescence, la photonique ou la plasmonique. Notre article détaille plusieurs aspects multidisciplinaires : (i) éléments nanophotoniques plasmoniques pour améliorer la fluorescence, (ii) antioxydants pour neutraliser les espèces réactives de l’oxygène omniprésentes dans l’ultraviolet et (iii) suppression du fond basée sur une compréhension rationnelle de ses origines physiques.
Référence : Prithu Roy, Jean-Benoît Claude, Sunny Tiwari, Aleksandr Barulin, and Jérôme Wenger, “Ultraviolet Nanophotonics Enables Autofluorescence Correlation Spectroscopy on Label-Free Proteins with a Single Tryptophan” Nano Letters 2023
https://doi.org/10.1021/acs.nanolett.2c03797
Financements : Ce projet a reçu un financement du Conseil européen de la recherche (ERC) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’Union européenne (accord de subvention n° 723241 TryptoBoost).
Contact Chercheur : Jérôme Wenger – Équipe MOSAIC, Institut Fresnel, Marseille - www.jeromewenger.com
La vie à haute température observée sous chauffage laser
Au fond des océans ou près des sources volcaniques, des micro-organismes ont su évoluer pour apprendre à vivre jusqu’à des températures extrêmes, même au-delà de 100°C. Observer ces organismes hyperthermophiles à de si hautes températures sous un microscope optique est une gageure. C’est pourtant la seule façon d’étudier leur métabolisme et leurs interactions.
Des chercheurs de l’Institut Fresnel (CNRS, Marseille) et de l’Institut de Biologie Intégrative de la Cellule (I2CB, université Paris-Saclay, Gif-sur-Yvette) ont mis au point une technique simple qui permet d’observer des hyperthermophiles vivre par microscopie optique haute résolution. La technique consiste à cultiver ces micro-organismes sur une lamelle de verre couvertes de nanoparticules d’or, et chauffer ces nanoparticules par une illumination laser. L’absorption intense des nanoparticules permet d’atteindre des températures arbitrairement élevées avec de faibles puissances laser. Cette technique est applicable sur n’importe quel microscope optique utilisé en biologie, et ne requiert pas l’implémentation d’un caisson chauffant. Elle nécessite juste l’utilisation d’une technique de microscopie de phase quantitative, pour cartographier la température aux petites échelles.
Dans un article publié dans Nature Communications, les chercheurs de l’institut Fresnel et de l’I2BC expliquent comment ils ont pu observer pour la première fois la bactérie Geobacillus stearothermophilus se diviser, nager, germiner, et étudier précisément sa vitesse de croissance en fonction de la température.
Ces travaux ouvrent la voie à l’étude de micro-organismes hyperthermophiles par une plus large communauté de biologistes, notamment celle de la bio-imagerie optique, en plein essor aujourd’hui, animée par le développement constant de nouvelles techniques de microscopies optiques permettant d’étudier le vivant à des échelles qui avoisinent le nanomètre, et en 3 dimensions.
Référence : Molinaro, C., Bénéfice, M., Gorlas, A. et al. Life at high temperature observed in vitro upon laser heating of gold nanoparticles. Nat Commun 13, 5342 (2022)
https://doi.org/10.1038/s41467-022-33074-6
Financements : Projet européen ERC HiPhore
Contact : Guillaume Baffou
Voir l’émission intrinsèque d’une seule protéine avec des antennes optiques ultraviolettes
Une nouvelle plate-forme d’antenne optique pour la détection sans marquage de protéines uniques dans l’UV avec des résolutions et une sensibilité sans précédent
L’un des objectifs ultimes de la biologie moléculaire est d’observer le fonctionnement des protéines individuelles dans leur état natif. Cependant, l’approche courante actuelle de la fluorescence à molécule unique repose sur l’introduction de marqueurs fluorescents externes qui peuvent entraîner des problèmes affectant les résultats expérimentaux. Comme alternative au marquage par fluorescence, travailler dans l’ultraviolet est séduisant pour profiter de l’autofluorescence naturellement présente dans la grande majorité des protéines. Cependant, les protéines émettent des ordres de grandeur moins que les colorants fluorescents conventionnels, de sorte que la détection UV d’une seule protéine est restée un défi jusqu’à présent.
Dans une publication récente dans Nature Communications, des chercheurs de l’Institut Fresnel présentent une nouvelle plate-forme d’antenne optique pour la détection sans marquage de protéines uniques dans l’UV avec des résolutions et une sensibilité sans précédent. L’approche combine (i) un réflecteur conique pour la collecte de fluorescence à des angles ultra-élevés avec (ii) une nano-ouverture métallique pour l’amélioration de la fluorescence et la réduction du bruit de fond. Pour démontrer expérimentalement l’utilité de notre approche et son application directe aux défis biochimiques, la détection en temps réel de l’autofluorescence UV à partir de protéines uniques immobilisées et diffusantes est démontrée, ainsi que des expériences surveillant la dénaturation d’une protéine. Fait important pour les applications biochimiques, toutes les expériences sur une seule molécule sont réalisées sur des protéines sans marquage et dans des conditions physiologiques, ce qui est unique dans ce domaine scientifique.
Les antennes optiques UV ouvrent une nouvelle forme de spectroscopie permettant l’étude de protéines individuelles dans leur état natif et en temps réel. Ce travail fournit un saut vers la conception d’essais biochimiques avec une résolution de protéine unique sans marquage ainsi que des nanosources optiques brillantes.
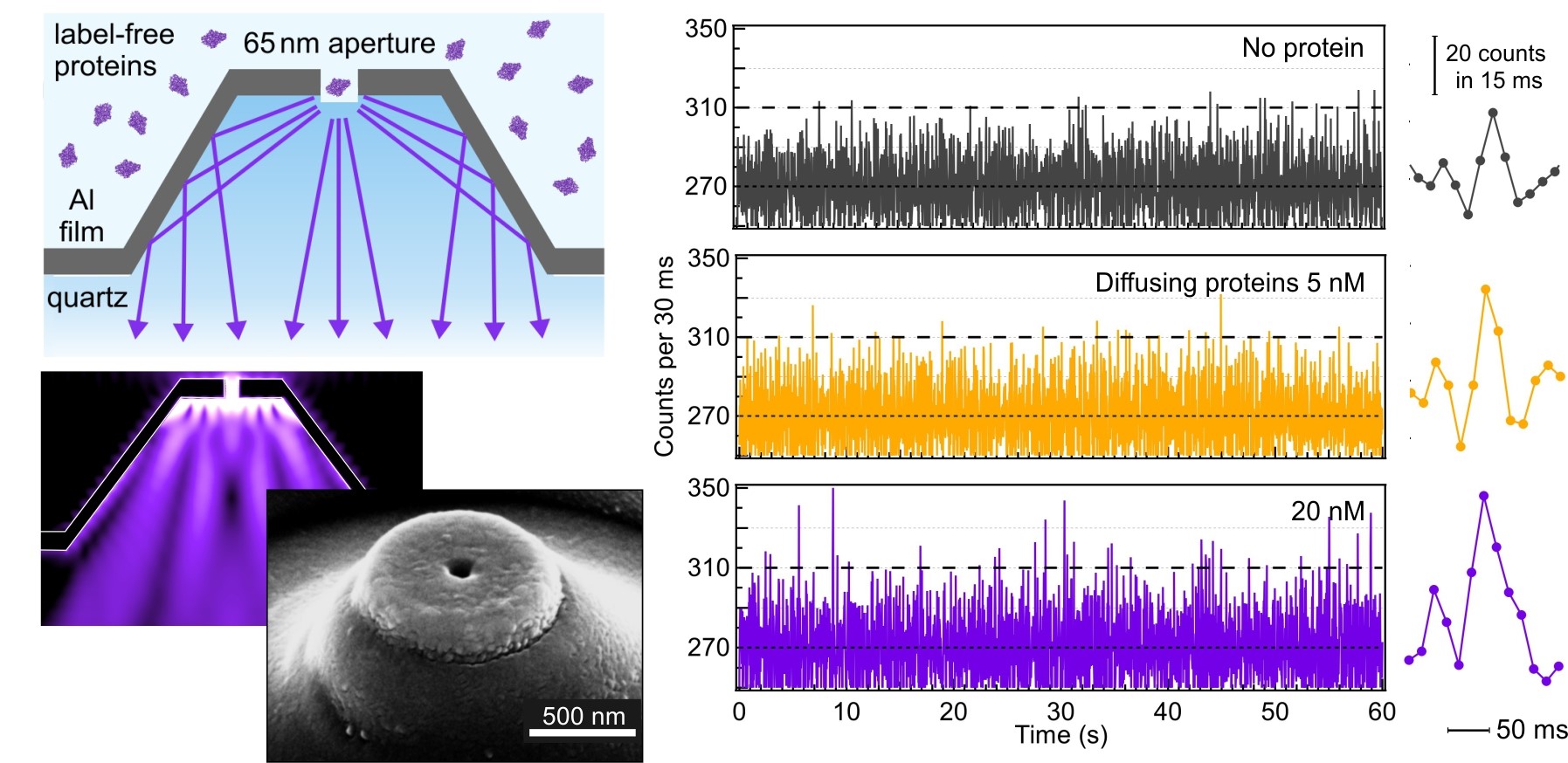
Optical horn antenna for single label-free protein detection in the ultraviolet.
Référence : "Ultraviolet optical horn antennas for label-free detection of single proteins" ; A. Barulin, P. Roy, J.-B. Claude, J. Wenger, Nature Communications, 5 avril 2022
https://doi.org/10.1038/s41467-022-29546-4
Financements : Ce projet a reçu un financement du Conseil européen de la recherche (ERC) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’Union européenne (accord de subvention n° 723241 TryptoBoost).
Contact Chercheur : Jérôme Wenger – Équipe MOSAIC, Institut Fresnel, Marseille - www.jeromewenger.com
Article sur le site de l’INSIS : "Observer une protéine unique sans marqueur grâce à une antenne optique dans l’ultra-violet"

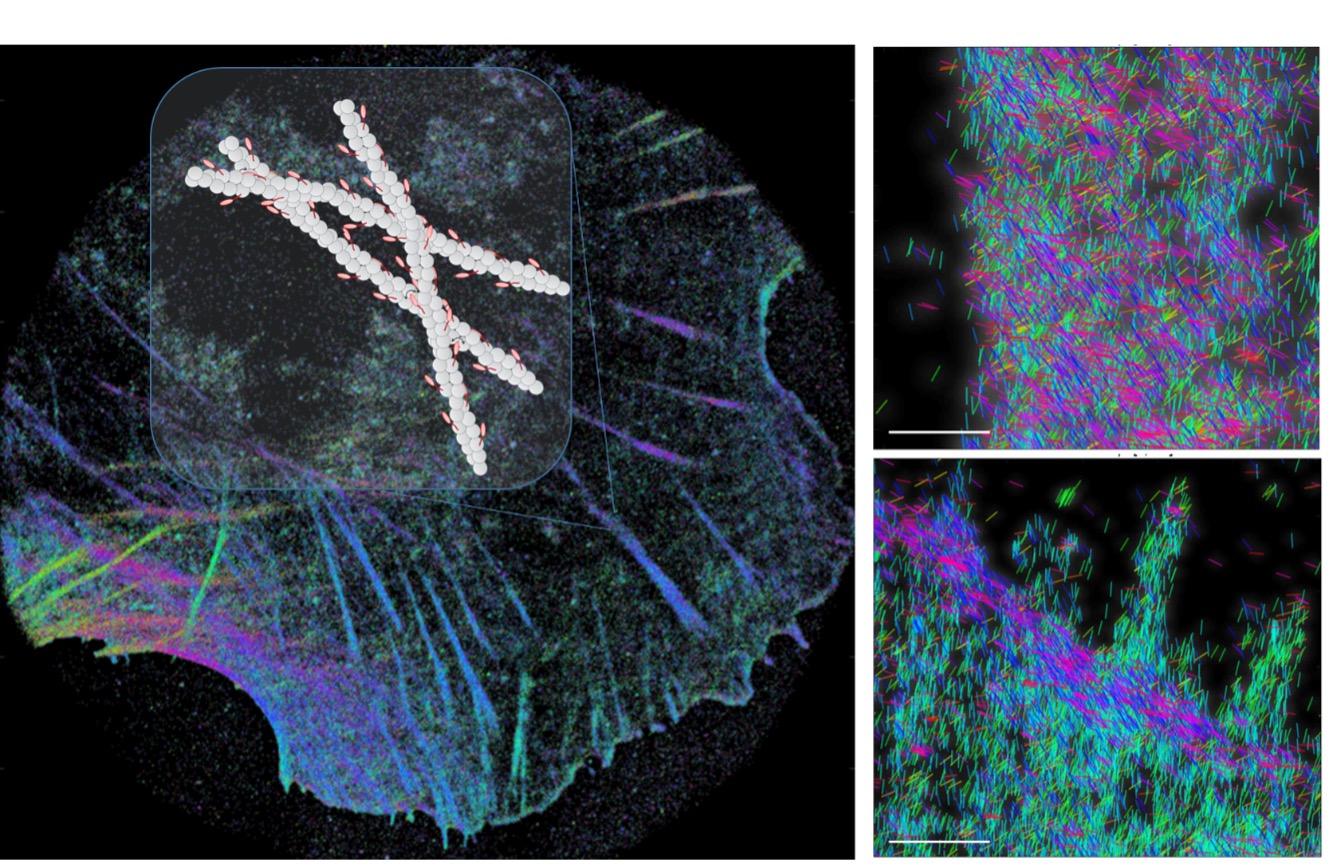
Révéler l’organisation de l’actine dans les Cellules par l’orientation de molécules isolées
Une nouvelle approche d’imagerie polarisée à base de localisation de molécules isolées fluorescente permet de révéler l’organisation de l’actine dans les cellules aux échelles nanométriques
Imager la manière dont sont orientées les protéines en 3D dans une cellule, tout en les positionnant à des dizaines de nanomètre de précision, est un défi pour l’imagerie optique. C’est pourtant ce qui permettrait de comprendre les processus qui relient les conformations et organisation des protéines, aux fonctions qu’elles exercent dans les cellules. Alors que quelques méthodes émergent aujourd’hui pour mesurer à la fois la position et l’orientation de molécules uniques fluorescentes dans des échantillons in vitro, ces approches sont encore limitées pour l’utilisation dans des environnements complexes comme les cellules, où les conditions de signal à bruit et de fond de fluorescence sont délicates. Une des raisons principales est que ces approches se basent sur un codage de l’information de l’orientation moléculaire dans la forme de l’image de chaque molécule, forme qui peut dépendre fortement des aberrations optiques produites dans le microscope et par l’échantillon. Les chercheurs de l’équipe MOSAIC de l’Institut Fresnel sont parvenus à mettre en place une stratégie basée uniquement sur une mesure de rapports d’intensités d’une même molécule, projetée sur quatre directions de polarisation. En concevant un système de détection optique de telle manière que ces signaux sont peu dépendants des paramètres qui pourraient biaiser les données, les chercheurs ont montré la possibilité de remonter à l’information de l’orientation de molécules marquant l’actine, un filament du cytosquelette des cellules. Ces filaments, par leur densité, sont parfois impossible à isoler sur une image, même super–résolue. Grâce à cette détection polarisée, il a été possible de mettre en évidence la manière dont les filaments s’organisent avec des orientations soit fortement parallèles, comme dans les fibres de stress, soit dans des distributions beaucoup plus complexes mais spécifiques comme dans le front de migration des cellules où l’actine est agencée de manière singulière. Ces images, bien qu’étant mesurées dans des conditions optiques donc compatible avec le vivant, se rapprochent d’une imagerie structurale, révélant la manière dont les protéines s’organisent à des échelles nanométriques.
Cette nouvelle approche, appelée 4polar-STORM (pour Stochastic Optical Reconstruction Microscopy polarisée sur 4 voies), est basée sur un lien étroit entre l’orientation du marqueur fluorescent et celle de la protéine qu’ils rapportent. En développant une ingénierie des liaisons entre les marqueurs fluorescents et ces protéines, il sera possible dans le futur de suivre, dans des échantillons vivants, la manière dont ces protéines modifient leur orientation au cours du temps. L’approche de microscopie super-résolue polarisée vient donc compléter l’imagerie super-résolue de fluorescence pour aborder de nouvelles questions en biologie sous un angle différent.
Référence : V C. Rimoli, C. Valades Cruz, V. Curcio, M. Mavrakis, S. Brasselet. 4polar-STORM polarized super-resolution imaging of actin filament organization in cells. Nat. Communications 13, 301 (2022)
https://doi.org/10.1038/s41467-022-27966-w
Financements : France BioImaging National Infrastructure (ANR-10-INBS-04), CENTURI convergence institute (ANR-16-CONV-0001), ANR SEPTIMORF (ANR-17-CE13-0014), ANR 3DPolariSR (ANR-20-CE42-0003). A*MIDEX (ANR-11-IDEX-0001), European Union’s Horizon 2020 research and innovation programme under the Marie Sklodowska-Curie (grant agreement No 713750), INRIA (projet NAVISCOPE-IPL).
Contact Chercheurs : Sophie Brasselet and Manos Mavrakis – Equipe MOSAIC, Institut Fresnel, Marseille


 ResearchGate
ResearchGate Flux RSS
Flux RSS