Ces travaux sont publiés dans le Journal of Cell Biology.
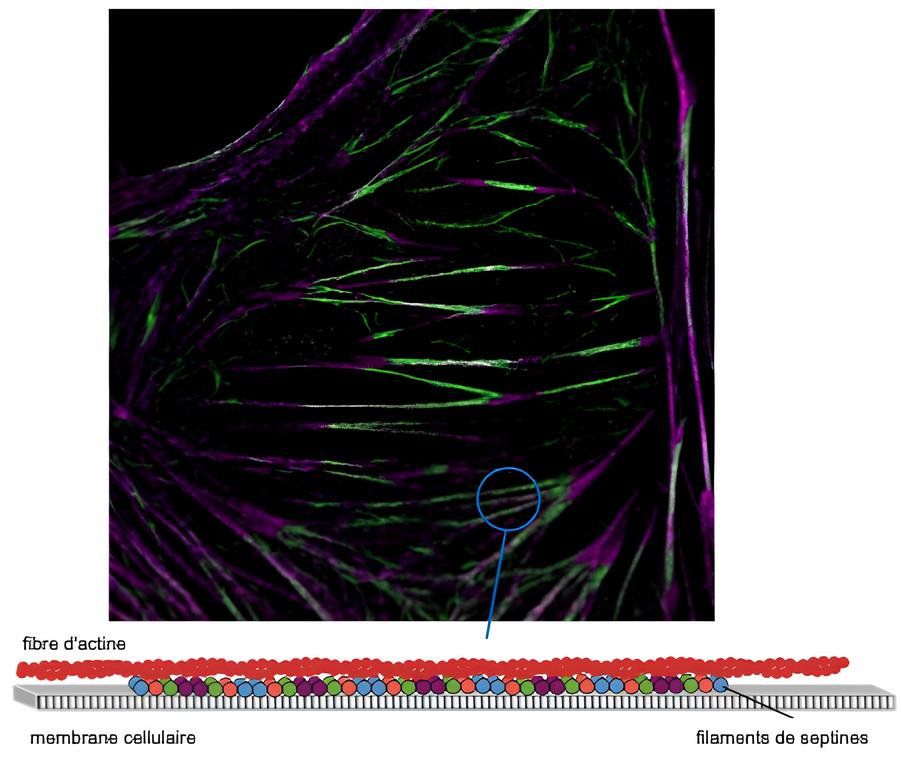
Un système rapporteur basé sur la fluorescence qui sonde les interactions spécifiques septine-septine révèle que les septines humaines dans les cellules s’organisent en filaments qui ancrent les fibres d’actine à la membrane cellulaire.
Les septines constituent une famille de protéines impliquées dans un large spectre de processus biologiques, de la division cellulaire à la motilité cellulaire et à la morphogenèse des tissus animaux. En physiopathologie humaine, un rôle des septines a été établi dans les neuropathies, l’infertilité et la tumorigenèse. Malgré leurs rôles essentiels, la façon dont les septines humaines s’organisent et fonctionnent dans les cellules reste mal comprise. Un travail collaboratif entre des biologistes de l’Institut Fresnel et du Centre de Recherche en Cancérologie de Toulouse (CRCT) et des physiciens de l’Institut Fresnel et de TU Delft (Martins et al. 2022) aborde cette question en combinant des études cellulaires avec des essais de reconstitution in vitro. En développant un système rapporteur basé sur la fluorescence comme signature moléculaire des interactions spécifiques septine-septine, les auteurs montrent que toutes les septines décorant les fibres d’actine dans les cellules s’organisent en filaments. Empêcher la polymérisation des septines compromet l’intégrité des fibres d’actine et réduit la rigidité des cellules. Des mesures de distance à résolution nanométrique ont également montré que les filaments de septine sont liés à la membrane. Enfin, des essais de reconstitution ont montré que les filaments de septine ancrent l’actine à la membrane. Cette étude montre que l’organisation des septines en filaments est essentielle à leur fonction d’ancrage et de stabilisation des filaments d’actine à la membrane plasmique.
Référence : Human septins organize as octamer-based filaments and mediate actin-membrane anchoring in cells, Carla Silva Martins, Cyntia Taveneau, Gerard Castro-Linares, Mikhail Baibakov, Nicolas Buzhinsky, Mar Eroles, Violeta Milanović, Shizue Omi, Jean-Denis Pedelacq, François Iv, Léa Bouillard, Alex Llewellyn, Maxime Gomes, Mayssa Belhabib, Mira Kuzmić, Pascal Verdier-Pinard, Stacey Lee, Ali Badache, Sanjay Kumar, Cristel Chandre, Sophie Brasselet, Felix Rico, Olivier Rossier, Gijsje H. Koenderink, Jerome Wenger, Stéphanie Cabantous, Manos Mavrakis in Journal of Cell Biology, 2022
– https://doi.org/10.1083/jcb.202203016
Contact : Manos MAVRAKIS – équipe MOSAIC – manos.mavrakis@univ-amu.fr
Partenaires : Cette recherche est le fruit d’une collaboration entre l’Institut Fresnel, le Centre de Recherche en Cancérologie de Toulouse (CRCT), le Laboratoire Adhésion et Inflammation (LAI), l’Institut Interdisciplinaire de Neurosciences (IINS), l’Institut de Pharmacologie et de Biologie Structurale (IPBS), le Centre de Recherche en Cancérologie de Marseille (CRCM), l’Institut de Mathématiques de Marseille (I2M), TU Delft, l’Université Monash et UC Berkeley.
Financements : Cette recherche a reçu plusieurs financements
– de l’Agence Nationale de la Recherche (subventions ANR-17-CE13-0014 SEPTIMORF. ; ANR-17-CE09-0026-01 AntennaFRET ; ANR-20-CE42-0003 3DPolariSR)
– de la Fondation ARC pour la recherche sur le cancer (subvention ARCDOC42020010001242) et des Cancéropôles PACA et INCa
– du Conseil Européen de la Recherche (ERC) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’UE (subventions n° 723241 et n° 772257) et de l’Union Européenne (subvention H2020-MSCA-ITN-2018 n°812772).
– de l’Organisation néerlandaise pour la recherche scientifique (NWO/OCW) (subvention Gravitation ’BaSyC-Building a Synthetic Cell’ (024.003.019)

